- Solutions
- Video
- Events
- News
- Landing
- Pages

di Comecer Regenerative Medicine Solution Staff
La produzione di massa di prodotti di Terapia Avanzata rappresenta tuttora una sfida solo parzialmente risolta ed in continua evoluzione. Davanti all’estrema variabilità insita nel concetto stesso di procedura cellulare, lo sforzo dell’operatore è quello di creare condizioni di crescita stabili per garantire riproducibilità e robustezza della procedura. Se nelle procedure singole si è raggiunto un sufficiente grado di confidenza, la transizione da un sistema di coltura individuale ad una produzione massiva non è mai banale, dato che una richiesta di aumento di volumi si traduce in una richiesta di spazi classificati aggiuntivi, spesso impossibile da realizzare, in ogni caso estremamente costosa. In aggiunta a ciò, un approccio commerciale evidenzia una richiesta di efficienza, che si traduce in attenzione sempre crescente alla flessibilità, alla modularità, alla riduzione dei costi. La soluzione proposta presenta un sistema modulare integrato (isolatore + incubatore) di manipolazione asettica ed espansione delle colture cellulari.
Tale sistema risponde ai più stretti requisiti di sicurezza, è modulare, espandibile e permette, nell’ottica di una produzione di massa, di superare il concetto di cleanroom, realizzando riduzioni significative dei costi di produzione dei prodotti di Terapia Avanzata.
Il tema della Medicina Rigenerativa, e quindi di argomenti quali Ingegneria Tissutale, Terapia Genica, Immunoterapia, Cellule Staminali e tematiche simili, è sempre più oggetto di ricerca, ingegnerizzazione e produzione e ha ormai varcato il confine dei soli addetti ai lavori per diventare, anche se con gradazioni e accezioni differenti, argomento di pubblica attenzione.
Per gli addetti ai lavori, tutti gli argomenti sopra riportati si riassumono con la sigla ATMP (Advanced Therapies Medicinal Products,) ovvero prodotti medicinali appartenenti alle cosiddette “Terapie avanzate” (http://www.agenziafarmaco.gov.it/it/content/terapie-avanzate), regolamentate e soggette alla normativa europea e in particolare agli “Annex 1 e 2” delle Good Manufacturing Practices (GMP), ovvero le norme di buona fabbricazione. Dal 2007 infatti, gli ATMP sono stati equiparati ai farmaci tradizionali (Regolamento 1394/2007 UE) e tutti i produttori di farmaci sterili devono seguire tali normative e certificare il proprio prodotto in conformità alle stesse, per poter ottenere autorizzazione alla vendita all’interno dell’Unione Europea.
In breve, un ATMP consiste in un preparato cellulare, la cui origine è un prelievo di tessuto umano. È assimilato ad un farmaco, in quanto lo scopo finale è la somministrazione terapeutica al paziente. I preparati cellulari sono classificati in: autologhi, per definire i preparati per i quali donatore e ricevente sono la stessa persona, eterologhi per indicare il caso in cui donatore e ricevente sono persone diverse. La normativa differenzia l’ATMP da un trapianto, che presuppone il prelievo di un organo e nessuna manipolazione sullo stesso, e pertanto è regolamentato da una normativa ad hoc. Il percorso per arrivare all’immissione in commercio è lungo e complesso e richiede una serie di requisiti che i produttori di Terapie Avanzate devono soddisfare per ottenere tale autorizzazione. Molti si sono adoperati e si stanno adoperando a questo scopo, con risultati lusinghieri soprattutto per i trattamenti autologhi. Le problematiche per la produzione di massa di questi medicinali però purtroppo vanno anche oltre la fase d’immissione in commercio. In particolare, quando si passa da piccole a grandi produzioni lo scenario cambia radicalmente, e a fronte di risultati importantissimi e procedure funzionanti e ripetibili ottenute per i casi singoli, diverse sono le difficoltà che ancora limitano l’applicazione massiva di queste tecnologie mediche.
Come già evidenziato in un precedente articolo a cura degli stessi autori (Sterility and Cross Contamination Challenges in Tissue Engineering and Regenerative Medicine), la produzione di ATMP rientra nel campo della fabbricazione di farmaci sterili ed è soggetta alla normativa riguardante gli stessi. Indipendentemente dalla normativa, anche agli occhi dei non addetti ai lavori, appare chiaro che un farmaco di origine cellulare, prodotto partendo da una biopsia tissutale e destinato ad essere reimpiantato in un paziente, deve essere sterile. Appare altresì evidente che, data la sua natura “vivente”, un ATMP non può essere sterilizzato alla fine del “processo produttivo”, ma deve essere mantenuto sterile per tutta la durata della sua manipolazione, fino all’impianto nel paziente. La problematica è ancora più delicata a causa di 2 motivi: la peculiarità e unicità del preparato (1 lotto = 1 paziente), e il rischio potenziale di crescita di contaminanti nell’ambiente di coltura, che per definizione è un terreno favorevole alla crescita cellulare.
Obbiettivo del ricercatore/laboratorista è quello di sviluppare procedure che possano essere riproducibili secondo un protocollo prefissato e più accurato possibile. Nelle procedure di fabbricazione a partire da una ricetta i fissa con ingredienti stabiliti la riproducibilità risulta facilmente ottenibile, mentre non è così ovvio quando si parla di colture cellulari. Sebbene il protocollo sia lo stesso, le caratteristiche peculiari di ciascun individuo fanno sì che i risultati ottenuti possano differire dalle attese, nonostante le condizioni “al contorno” siano le stesse. Da qui la conclusione che per fare in modo che la riproducibilità possa essere mantenuta al massimo grado (seppur non garantita), le condizioni di coltura debbano essere il più possibile costanti.
La robustezza di una procedura è intesa come la capacità di resistere alle perturbazioni e di conservare l’integrità. Se la procedura è robusta, il suo percorso non viene alterato facilmente da eventuali perturbazioni. Se il flusso di processo viene alterato, questo ritorna il più velocemente possibile alle condizioni di lavoro programmate.
Questo implica, nel caso delle colture cellulari, la realizzazione di condizioni “al contorno” stabili, la predisposizione di meccanismi che garantiscano un rapido ritorno alle condizioni iniziali in caso di perturbazione e, laddove possibile, la prevenzione per minimizzare il verificarsi di possibili perturbazioni.
La domanda d’obbligo è: i sistemi sanitari nazionali saranno in grado di assolvere alla richiesta di nuove terapie e soprattutto, saranno in grado di permettersele? Questo scenario evidenzia chiaramente la vera sfida degli ATMP: la sostenibilità economica della gestione e somministrazione della terapia stessa.
In questo scenario, da un punto di vista operativo e pratico, si evidenziano almeno tre macro problematiche differenti:
In realtà vi sono altre tematiche di rilievo, ma in questa analisi proveremo a concentrarci su quelle che appaiono come ostacoli particolarmente ostici da superare. Analizzando quelli che, a nostro parere, sono i limiti correnti proveremo a capire se ci sono soluzioni tecnologiche che, applicate alle problematiche in oggetto, possano semplificare la strada per la diffusione di massa di queste terapie, favorendo l’accesso alle stesse da parte di un numero elevato di pazienti, garantendo la qualità del processo e abbassandone i costi di produzione.
Il percorso di un farmaco ATMP nasce in un laboratorio di ricerca, dove la terapia viene messa a punto. In laboratorio si fanno le ipotesi, le prime verifiche, spesso gli esperimenti in vitro e quelli in vivo su cavie. Questa fase è senz’altro pionieristica, durante la quale si lavora solitamente con una cappa a flusso laminare, dove vengono effettuate le manipolazioni più critiche in termini di sterilità. Inoltre in questa fase vengono utilizzati incubatori, centrifughe da laboratorio, consumabili a prevalente uso manuale e si fa uso di una grande quantità di disinfettanti spray per decontaminare il campo di lavoro e gli strumenti.
Nel momento in cui una procedura dimostra la sua efficacia in fase preclinica, occorre predisporre il passaggio allo studio clinico, tipicamente con la Fase I, ovvero la prova di non tossicità. Per la produzione di una serie di “lotti” (il concetto è un po’ forzato trattandosi di medicinali autologhi, ma rende bene l’idea) occorre trasferire la produzione all’interno di una officina di produzione sterile, autorizzata dall’EMA (European Medicine Agency e AIFA – Agenzia Italiana del Farmaco – in Italia), ovvero in una cleanroom o in una struttura equivalente. Tale struttura prevede l’autorizzazione alla produzione secondo la procedura specifica ed è soggetta a strettissime regole di controllo e a validazione periodica.
In ambiente sterile i campioni biologici vengono manipolati, espansi in appositi incubatori, centrifugati, contati e preparati, in generale, per la reinfusione nel paziente. Tale preparazione è svolta in accordo alle più stringenti norme di sterilità, a garanzia della qualità del prodotto. Tali norme, riassunte nella tabella allegata, vengono rispettate in un ambiente schematizzato come in Figura 1, che rappresenta appunto una tipica cleanroom.
All’interno della cleanroom trovano posto nelle zone di grado “B”, tutte le strumentazioni, mentre sotto la cappa a flusso laminare (rappresentata dall’area di grado “A” in Figura 1) avvengono le manipolazioni a cielo aperto, ovvero dove si prevede che il preparato sia a contatto con l’ambiente.
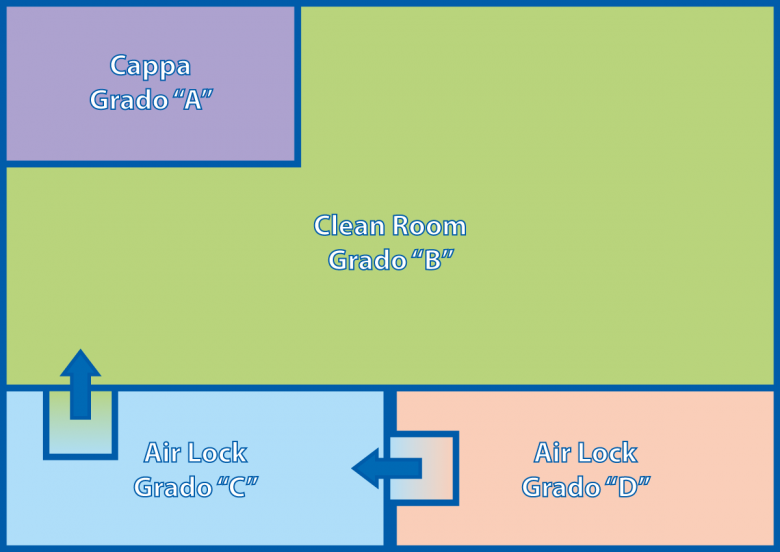
Fig. 1
Allo stato attuale, la produzione di ATMP in accordo allo schema proposto richiede che ogni cleanroom sia destinata ad uno specifico prodotto e dedicata esclusivamente su una specifica applicazione.
Il cuore della coltura è costituito dall’incubatore. Come sappiamo, l’incubatore è un ambiente dove temperatura e umidità vengono monitorate e mantenute costanti, viene fornita una miscela di aria condizionata con CO2, al fine di riprodurre le condizioni fisiologiche per la proliferazione cellulare. Durante il periodo di incubazione, a seconda dell’applicazione si accede ripetutamente alle colture conservate in incubatore, per osservazione, campionamento, aggiunta di materiali di coltura etc. Ogni qualvolta sia necessario accedere alla coltura, gli operatori accedono in regime di vestizione sterile all’area di grado “B”, aprono l’incubatore (che quindi si apre sempre in area “B”), e portano le colture sotto la cappa a flusso laminare in grado “A” dove effettuano le manipolazioni.
La possibilità di espandere la capacità produttiva del laboratorio molto spesso è minima, in quanto lo spazio classificato come “grado B” di norma è già totalmente sfruttato. Una possibilità potrebbe essere rappresentata dall’aggiunta di qualche stazione di incubazione, che in ogni caso porterebbe in breve tempo alla saturazione dello spazio. Inoltre, le apparecchiature da aggiungere devono essere poste in area classificata ed effettuare modifiche in tali condizioni non è mai banale, richiede impegno di risorse, tempo, ed investimenti finanziari. Tipicamente infatti l’espansione della capacità produttiva di un sito passa necessariamente attraverso l’espansione fisica della superficie occupata dalle aree classificate.
Al termine di una procedura, della preparazione di un lotto, di una sessione paziente, e anche periodicamente occorre “ripulire” l’incubatore, oltre che la cleanroom, ed avviare una sessione di decontaminazione di tutte le superfici, dei macchinari e dei materiali utilizzati. I migliori incubatori sul mercato sono dotati di un sistema di sterilizzazione a vapore che, pur garantendo risultati più che accettabili in termini di qualità del servizio, rendono inoperativo l’incubatore per diverse ore (spesso per più di 10 ore) ed impattano sulle condizioni ambientali della cleanroom (riscaldamento). La pulizia della cleanroom viene poi eseguita in maniera sterile da operatori dedicati, nelle stesse condizioni di lavoro degli operatori certificati.
La tecnologia di isolamento, in accordo all’Annex 1 delle GMP, comporta la creazione di ambienti totalmente separati dall’operatore, all’interno dei quali viene mantenuto il grado “A” di pulizia particellare e microbiologica.
In accordo alla normativa sopra menzionata, un isolatore può essere collocato in un’area di grado “D”, consentendo agli operatori di muoversi in un’area con vincoli di classificazione decisamente inferiori a quelli del grado “A” e “B” della cleanroom.
Già da tempo COMECER ha realizzato un isolatore specificatamente dedicato all’attività di coltura cellulare (Fig. 2).

Fig. 2
Questo isolatore integra al suo interno tutti i dispositivi principali (incubatore, centrifuga, microscopio, dispositivi di riempimento, refrigerazione, e stoccaggio materiali), permettendo agli operatori di effettuare le operazioni che solitamente svolgono all’interno di una cleanroom, completamente all’interno dell’isolatore, senza alcuna contaminazione e contatto con l’esterno, sempre con la continuità del grado “A”. I movimenti degli operatori sono minimi, le colture sono esposte solo al grado “A”, e non ci sono trasporti di colture se non per minime distanze all’interno dell’isolatore stesso. Pertanto i tempi di lavorazione sono ridotti e l’efficienza produttiva risulta aumentata. Nel momento in cui si rende necessario, la sterilizzazione degli incubatori avviene contemporaneamente a quella degli isolatori in cui sono integrati, per mezzo di un ciclo di sterilizzazione a vapori di perossido di idrogeno (VPHP), considerato il Gold Standard per la sterilizzazione in ambito biologico.
Tali peculiarità dell’isolatore e le considerazioni derivanti forniscono una risposta a due delle maggiori problematiche evidenziate, quali l’efficienza e minimizzazione degli spostamenti, l’efficacia ed economicità del processo di sterilizzazione, ma aggiungono poco in termini di flessibilità, di modularità delle installazioni e di espandibilità delle configurazioni esistenti.
Flexycult™ (Fig. 3) è un sistema modulare di incubazione, specificatamente pensato per essere utilizzato in accoppiamento alla tecnologia ad isolatore.

Fig. 3 Flexycult System
Il sistemaconsta di una serie di moduli, dove ogni modulo rappresenta un incubatore, integrati in una Docking Station (Fig. 4) , attraverso la quale condividono le utilities necessarie al loro funzionamento (potenza elettrica, aria calda umidificata, CO2, sistema di decontaminazione etc).

Fig. 4 Flexycult Docking Station
Il sistema è disponibile nella configurazione da 3, 6, o 9 moduli.
Gli incubatori vengono sterilizzati con un ciclo di perossido di idrogeno in fase vapore prima dell’avvio della procedura, e sono alimentati attraverso un sistema di filtraggio HEPA 14 integrato, che garantisce il mantenimento del grado “A”.
Per poterne manipolare il contenuto, l’incubatore viene accoppiato all’isolatore attraverso una connessione RTP a tenuta sterile (Fig. 5) e pertanto gli incubatori vengono aperti solamente all’interno di un’atmosfera garantita in grado “A”.

Fig. 5 RTP connection
Dato che l’incubatore rispetta le stesse condizioni dell’isolatore, essendo a tutti gli effetti in comunicazione con l’esterno solo in ambiente classificato “A”, può essere collocato in ambienti di grado “D”, in accordo alle GMP. Questo approccio comporta quindi un evidente risparmio in termini di classificazione degli ambienti. La procedura di collegamento-scollegamento, utilizzazione e ritorno in posizione è descritta in Fig. 6.

Fig. 6 Schema di utilizzo
A questo punto, eliminato il vincolo di classificazione dell’ambiente in cui gli incubatori sono collocati, l’espansione non rappresenta più un grande problema. Infatti, al bisogno, è possibile aggiungere una serie di moduli, in un’area a minore classificazione, con evidente incremento della flessibilità operativa, ottimizzazione dei costi, di impegno logistico e di personale.
La gestione della fluidica è centralizzata: la miscela di aria, vapore acqueo e CO2 viene preparata e pre-riscaldata, immessa nell’incubatore attraverso un flusso unidirezionale orizzontale (Fig. 7) che garantisce uniformità nella distribuzione della miscela e quindi delle condizioni di temperatura, umidità relativa e concentrazione di CO2. La presenza di un flusso unidirezionale orizzontale contribuisce a mantenere la pulizia dell’ambiente (Fig. 8).

Fig 7 Homogenous air flow speed

Fig 8 Homogenous air flow direction
Tutte le transizioni e i parametri significativi sono monitorati e remotati su una stazione digitale (Fig. 9) che assicura massima tracciabilità delle operazioni, dei contenuti e delle condizioni ambientali, garantendo la supervisione del processo e la pronta reazione in caso di scostamento dalla procedura.
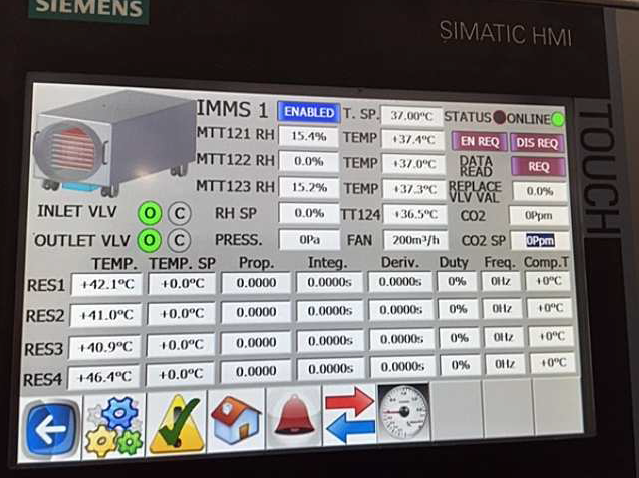
Fig. 9 Interfaccia di monitoraggio e controllo
Per raccogliere in maniera organica quanto esposto, possiamo riassumere le caratteristiche del prodotto Flexycult™ nella tabella seguente:
| Caratteristica | Vantaggio | Beneficio |
| Modularità | Espandibilità progressiva | Migliore gestione del capitale e dello spazio |
| Flessibilità in configurazione | Migliore gestione dello spazio | |
| Sterilizzazione a VPHP | Gold Standard nella sterilizzazione e procedura di pulizia automatizzata | Risparmio di tempo e massima efficacia |
| Distribuzione Aria Umidificata | Nessun serbatoio di acqua interna | Migliore pulizia, accuratezza e protezione da contaminazione |
| Centralizzazione dei Fluidi | 1 solo collegamento per le utilities a n. incubatori | Meno cablaggi, più linearità nel controllo |
| Flusso laminare e Grado A | Maggiore pulizia di gestione. Nessun contatto operatore-prodotto. | Diminuzione del rischio di decontaminazione |
| Apertura in isolatore | Continuità del grado A | Diminuzione del rischio |
| Ambiente sigillato | Possibilità di collocazione in grado D | Riduzione dell’area classificata |
| Riscaldamento a parete | Rapido ritorno alle condizioni di incubazione (recovery time) | Perfetta uniformità di temperatura e stabilità delle condizioni ambientali |
| Moduli monolotto | Nessuna contaminazione incrociata | Diminuzione del rischio |
| Connessione Digitale | Massimo livello di monitoraggio | Controllo continuo anche da remoto e pronta reazione |
Il sistema presentato rappresenta una proposta alternativa alla classica moltiplicazione degli spazi classificati per espandere la capacità produttiva delle officine farmaceutiche dedicate alle terapie avanzate. Le principali limitazioni dell’approccio corrente nell’adattarsi ad una diversa richiesta (incremento dell’area classificata, incremento delle capacità di incubazione, possibilità di lavorare con lotti multipli, mantenimento dello standard qualitativo, riduzione dei costi per lotto di produzione) sono superati da un approccio modulare. L’approccio modulare infatti consente la condivisione di alcuni servizi tra diversi moduli, la possibilità di collocazione in aree a classificazione inferiore, la costanza delle condizioni ambientali anche in presenza di carichi di lavoro aumentati, la completa rimozione del rischio di cross contamination, e un approccio integrato (incubatore + isolatore) che favorisce una riduzione dei costi di esercizio ed un miglior rapporto costo/beneficio.
Accedi e scarica ora
Log In Recupero passwordNovità, inviti ad eventi e fiere direttamente nella tua casella di posta
Iscriviti

